人CD4+CD25+Treg细胞分选、扩增、分子以及抑制功能检测
返回 T细胞
该应用方案中,利用Treg 扩增试剂盒,人,有效扩增 CD4+CD25+Treg细胞分离试剂盒分离的Treg表达Foxp3。它包括一个Treg细胞完整的工作流程,描述从外周血单个核细胞(PBMCs)分离人Treg细胞,细胞体外扩增,以及随后的流式细胞分析。
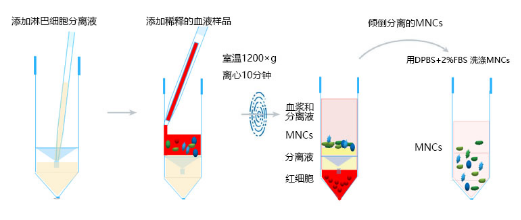
01. PBMC分离 | |||
免疫密度梯度离心分离PBMC | |||
所需试剂 | 操作流程 | ||
Septube-15密度梯度离心管(PBM,#601115) | 1.将淋巴细胞分离液通过隔板中心的孔注入 SepTube管。 注入分离液的体积请参考下表。 | ||
Septube™密度梯度离心管 | 起始样本(mL) | 密度梯度离心液(mL) | |
| 15 | 0.5-5.0 | 4.5 | |
| 50 | 4.0-17.0 | 17.0 | |
2. 抗凝血用等体积 D-PBS 稀释,混合均匀。如:5 mL 抗凝 血用 5 mL D-PBS 稀释。 3. 保持 SepTube管垂直,通过血清移液管将稀释的样品沿 管壁加入管中。样品将会和隔板上方的分离液混合,但不会影响分离效果。 注:样品也可以直接倒入 SepTube®管中,但要小心避免样品通过隔 板中央的小孔直接进入隔板下方的分离液中。 4. 在开启离心机制动器的情况下,室温 1200×g 离心 10 分钟。 注:如果样品在体外超过 24h 以上,建议离心 20 分钟以上。离心力(g)和转速(rpm)转换公式:
注:rpm:每分钟转速;RCF:相对离心力;Radius:离心机转子半 径(cm) 5. 离心完成后,可以将最上层不含细胞的 D-PBS 稀释液吸出弃掉,或者直接将包含 MNCs 的上层稀释液直接倒入新的无菌离心管中。请勿倒置 SepTube®管超过 2 秒,以免底层红细胞倒出。 注:离心后,SepTube®隔板上表面可能存在少量红细胞,但这些少量的红细胞不会影响下游实验和细胞分离效果。如果 SepTube®隔板上表面发现有较多的红细胞,可能是由于采血时间较长引起的,此时可以继续 1200×g 离心 10 分钟,以减少红细胞的残留。 6. 向分离的 MNCs 中添加 0.5-1 倍体积 D-PBS (2μM EDTA) + 2% FBS,室温 300×g 离心 8 分钟洗涤细胞。 注:为去除分离 MNCs 中的血小板,可以关闭离心机制动器,室温120×g 离心 10 分钟洗涤 MNCs。 | |||
02. Treg细胞分离 | |
| 所需试剂 | 操作流程 |
CD4+CD25+ Regulatory T Cell Isolation Kit, human (MB,# 130-091-301) ImunoSepTM Buffer (500 mL)(Novo,#604050) LD Columns, 1 for 1×108 labeled cells (MB,# 130-042-901) MS Columns, 2× per isolation (MB,# 130-042-201) MidiMACS™ Separator (Separator for LD Column), (MB,# 130-042-302) MiniMACS™ Separator (Separator for MS Column), (MB,# 130-042-102) MACS MultiStand (MB,# 130-042-303) (Optional) Pre-Separation Filters, 30 µm (MB,# 130-041-407) | 磁珠标记非CD4+细胞 注意: 所有下列步骤,非CD4T细胞的磁性标记和去除,CD25细胞的磁性标记和分选,都是使用人CD4+CD25+Treg分选试剂盒进行。使用人CD4+CD25+Treg分选试剂盒从全血样本中可同时分选Treg和Tresp 细胞。Treg细胞(CD4+CD25+) 是最后的阳选部分,而Tresp细胞(CD4+CD25-) 是最后阴选的部分。 下面给出的磁性标记的细胞多达 1×10⁷。 当起始细胞少于 1×10⁷ ,用相同的体积。当起始细胞更多,有根据的调整实际体积和总体积。 (例如.,对于 2×10⁷ 细胞,使用试剂的体积和总体积都是原来的2倍)。 1. 含3%乙酸的亚甲基蓝进行有核细胞计数(见:http://www.nwbiotec.com/index.php?g=&m=article&a=new_nav_list&newid=267)。 2. 300 x g离心10分钟,弃上清。 3. 重悬至1 x 107细胞/90µL缓冲液。 4. 每1 x 107细胞中加入10 µL 生物素标记的CD4+T 细胞抗体混合物。 5. 混匀,2-8℃孵育5分钟。 6. 每1 x 107细胞中加入20 µL抗生物素磁珠。 7. 混匀,2-8℃孵育10分钟。 8. 用缓冲液将反应体积调整到500µL。 磁性去除非CD4+T细胞
1.将LD分选柱置于Midi分选器。 2.用2 mL缓冲液润洗分选柱,直到柱子中的润洗也全部流出再进行下一步。 3. 将细胞悬液加入分选柱。 4. 收集通过分选柱的细胞。 5. 用2 x 1 mL缓冲液清洗分选柱。收集所有的馏分并与步骤4的细胞混合。混合后的细胞即为预富集的CD4+细胞。 6.计数细胞(见:http://www.nwbiotec.com/index.php?g=&m=article&a=new_nav_list&newid=267)。 磁性标记CD25+细胞 1. 300 xg离心细胞10分钟,去掉上清。 2. 将细胞重悬至1 x 107细胞/90µL。 3. 每1 x 107细胞中加入10 µL CD25磁珠。 4. 混匀,2-8℃孵育15分钟。 5. 通过添加1-2mL缓冲液和300 x g离心10分钟,清洗细胞。 6. 将细胞重悬至1 x 108细胞/500µL。 磁性分选CD25+细胞 注意: Treg分选的第二步是正选CD25+细胞。这一步,需要2根MS柱,容纳1×10⁷ 标记的细胞。不要超过柱子容量,推荐分选之前流式分析悬液中CD25+的含量。 1. 将MS分选柱置于Mini分选器. 2. 用500µL缓冲液润洗分选柱。 3. 将细胞悬液加入分选柱。 4. 收集通过分选柱的细胞。 5. 用3 x 500µL缓冲液清洗分选柱。收集通过分选柱的未经标记的细胞,并与来自步骤4的细胞混合。 6. 拿出分选柱将其置于一支细胞收集管上。 7. 分选柱中加入1 mL缓冲液,迅速推动分选柱活塞,洗脱磁性标记的细胞 8. 为了提高CD4+CD25+细胞的纯度,洗脱部分可以在第二个MS柱上再次富集。 |
| 03.Treg细胞与Tresp细胞流式检测 | |
| 所需试剂 | 操作流程 |
CD4 Monoclonal Antibody (RPA-T4), FITC( eBioscience,#11-0049-42) CD25 Monoclonal Antibody (BC96), PE(eBioscience™,#12-0259-41) 流式缓冲液(eBioscience,#00-4222-26) 5 mL流式管 (12×75 mm)(corning, #352058) | 为了检测分选的Treg和Tresp细胞的纯度,通过流式检测最终的正选(Treg)和阴选部分(Tresp)。推荐分析起始样本(即PBMC分离后的样本)。 下面给出的磁性标记的细胞多达 1×10⁷。 当起始细胞少于 1×10⁷ ,用相同的体积。当起始细胞更多,有根据的调整实际体积和总体积。 (例如.,对于 2×10⁷ 细胞,使用试剂的体积和总体积都是原来的2倍)。 免疫荧光染色 1.制备单细胞悬液。 1. [可选]染色前,将细胞用10 µL纯化的人Fc受体结合抑制剂/50 µL细胞 2-25°C预孵育10-20分钟。 2. 每个管中加入等量的50 µL细胞悬液(105-108个细胞) 3. 将CD4和CD25抗体各5 μL在40 µL的流式细胞术染色液中进行混合并加入到细胞中,使最终的染色体积为100 µL(即50 µL细胞样品 + 50 µL混合好的抗体混合物)。 轻轻地涡旋混合。 4. 2-8°C或冰上孵育30分钟以上。避光。 5. 加入流式细胞术染色液洗涤细胞。对于微量滴定板,使用2 mL/管或200 µL/孔。 在室温下400-600 x g离心5分钟。 弃上清。通常保留约100 μL残余体积。 6. 重复步骤5。 7. 将染色细胞重悬于适当体积的流式细胞术染色液中。 8. 通过流式细胞术分析样品。 |
| 04.Treg细胞激活、扩增 | |
| 所需试剂 | 扩增流程 |
TexMACS GMP Medium(MB,#170-076-307) β-Mercaptoethanol (β-ME) Penicillin/streptamycin (PenStrep)(BI,#03-031-1B) (Optional) Rapamycin (biogems,#5318893) Treg Expansion Kit, human: 2 mL for stimulation of 1×107 Treg cells (MB,# 130-095-345) 96-well round-bottom plate (Optional) 24-well plate (可选)MACSiMAG™ Separator (MB,# 130-092-168) | 准备Treg扩增培养基 无菌4℃条件下,培养基可以储存10天。 500 mL TexMACS™ Medium 该Treg扩增试剂盒是基于预负载CD3和CD28抗体的Macsibead™颗粒。 最佳的Treg细胞扩增通过Macsibead颗粒和Treg细胞4:1实现。 准备Treg细胞 1. 确定细胞浓度和Treg总量。 2. 5-10倍体积的培养基加入细胞,300x g离心10分钟,弃上清。 3. 用培养基将细胞重悬至1×106 细胞/mL ,吸取100 μL细胞悬液加入96孔板的1孔。 准备CD3/CD28 MACSiBead 颗粒 注意:
1.彻底涡旋MACS微珠颗粒并在合适的管中加入4倍量细胞体积的微珠颗粒(例如,用于扩增1×106个Treg细胞,转移4×106(=200µL)的MACSsibead颗粒),彻底悬浮CD3/CD28 Macsibead颗粒。 2. 加入300~600μL培养基,在300×g下离心5分钟,清洗Macsibead颗粒。 弃上清。 3.在扩增培养基中悬浮CD3/CD28MACSibead颗粒,最终浓度为2×10⁷珠子/mL(例如,4×106Macsibead颗粒时,悬浮在200µL扩增培养基中)。 Treg细胞与MACSibead颗粒共培养 1.在含有Treg细胞的每孔中加入20μL CD3/CD28 MACSibead颗粒。 由于MACSibead颗粒沉降迅速,颗粒悬浮液应在加入培养孔前不时涡旋。 2.现在,每个培养孔的最终体积是120µL。Treg细胞和MACSibead颗粒在37℃、5-7%CO2下孵育一天。 扩增过程 1. 第1天,每孔添加100μL培养基。 2. 在第3-5天(根据培养基的使用情况(颜色)),按1:2比例分配细胞或者用200µL新鲜培养基重悬细胞或吸出100µL培养基,加入100μL含500 U/mL IL-2的新鲜培养基。 3. 在第5-8天,将Treg细胞以更大体积(5×105 Treg/ 500 µL)转移到24孔培养板中,或在96孔板以1:2比例进行分配或者用200µL新鲜培养基重悬细胞。 4. 第14天,计数细胞并进行下游实验。至此Treg扩增过程可以停止,也可以通过重新刺激Treg细胞来进行。 如果在这里停止Treg的扩增,可通过进行表面和细胞内染色评估扩增的结果来确定FoxP3表达细胞的总细胞数和频率。 如果想继续刺激,CD3/CD28MACSi珠颗粒可以在重新刺激之前被移除。 有关详细信息,请参阅“Treg细胞的再刺激”。 |
| 05.Treg细胞再刺激 | |
| 所需试剂 | 操作流程 |
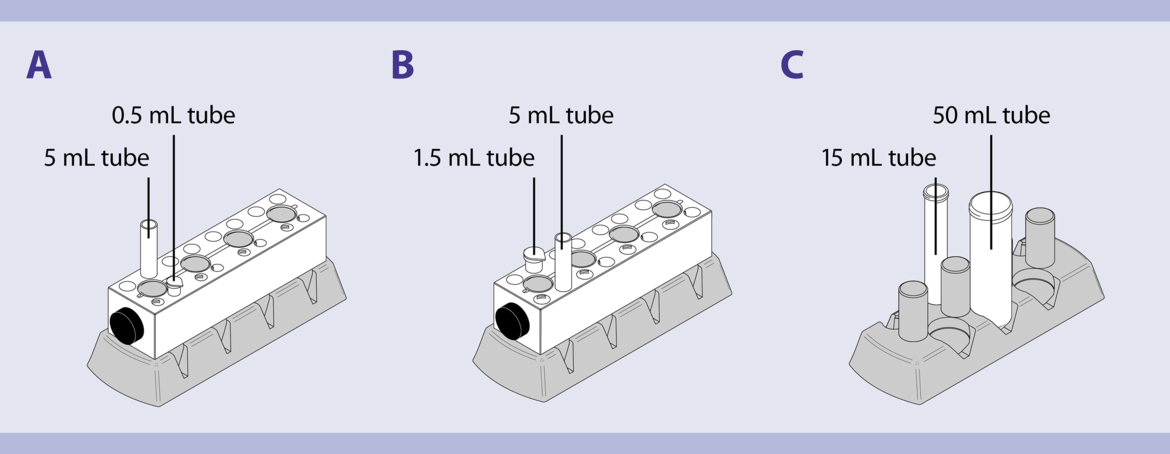
去除MACS微珠颗粒 1. 将相同处理条件处理的培养孔中的细胞收集在一起。用冷的分选缓冲液冲洗空培养孔,冲洗培养板上残留的细胞。 2. 细胞计数,并用分选缓冲液重悬细胞至2×107细胞/mL。 3. 将管子置于磁极中。 4. 使MACS微珠颗粒吸附在管壁。 5 mL 管子: 2分钟 5. 将管子仍然置于MACSiMAG 磁极中, 小心移出细胞悬液,转移至新管。 6. 将管从磁极中拿下来,加入与先前一样多的缓冲液 7. 涡旋样本,将管子置于MACSiMAG 分选器并重复步骤4-5。 8. 收集到的细胞可用于下游研究。
(A) MACSiMAG Separator with tube rack positioned for tubes of 5 mL or 0.5 mL in size. (B) MACSiMAG Separator with tube rack positioned for tubes of 1.5 mL or 5 mL in size. (C) MACSiMAG Separator with 15 mL and 50 mL tube. Treg细胞再刺激 注意:为了分析T细胞激活,收集刺激48小时的样本并染色早期活化标记CD25和CD69,检测活化的细胞在CD3+细胞中的比例。 注意:一定程度上,高度活化的T细胞会下调CD3的表达。或者,CD4和CD8染色(例如,带有CD4-VioBlue和CD8-VioGreen)可用于在T细胞亚群的刚刚弄好设门。
1. 第15天: 再刺激时,96孔培养板,每孔加入100 µL完全扩增培养基;24孔培养板每孔加入500 µL 完全扩增培养基。 2. 第17-19天(根据培养基的使用情况(颜色)),按1:2比例分配细胞,每孔加入1 mL完全培养基或者吸出500µL培养基,再加入500μL新鲜的完全培养基。 3. 第21天:21天后,Treg的扩增应该停止。为了评估扩增的结果、确定细胞总量、表达FoxP3细胞,可通过细胞表面和细胞内流式染色进行。 | |
| 06.抑制功能实验 | |||||
| 所需试剂 | 操作流程 | ||||
TexMACS GMP Medium(MB,#170-076-307) Penicillin/streptamycin (PenStrep)(BI,#03-031-1B) Treg Suppression Inspector, human (# 130-092-909), for stimulation of 5×107 total cells 96-well flat-bottom plate CFSE(eBioscience,#65-0850-84) 或者 CellTrace™ Violet Cell Proliferation Kit, for flow cytometry(invitrogen ,#C34571) |
96孔培养板的每孔中Treg细胞、Tresp细胞和TregSuppression Inspector(含MACSibead颗粒)的数量 | ||||
| Tresp:Treg | Tresp | Treg | TregSuppression Inspector | ||
| 1:0 | 5×104 | --- | 5×104 | ||
| 1:1 | 5×104 | 5×104 | 1×105 | ||
| 2:1 | 5×104 | 2.5×104 | 7.5×104 | ||
| 4:1 | 5×104 | 1.3×104 | 6.3×104 | ||
| 8:1 | 5×104 | 6×103 | 5.6×104 | ||
| 0:1 | --- | 5×104 | 5×104 | ||
| 1:0 | 5×104 | --- | --- | ||
| 0:1 | --- | 5×104 | --- | ||
| 总量 | 3×105 | 2×105 | 4×105 | ||
| 三次重复总量 | 9×105 | 6×105 | 1.2×106 | ||
荧光标记Tresp细胞 注意: 为了在体外抑制试验中监测Tresp细胞的增殖,细胞必须用荧光染料染色,这可以跟踪细胞的分裂,例如使用CellTrace™ Violet Cell Proliferation KIT或者CFSE。 有关更多信息,请参阅制造商的指示。本应用方案中显示的数据是用细胞追踪紫细胞增殖试剂盒获得的。 准备细胞 1. 计数Treg 和Tresp 细胞。对于一种检测,如上表中所述,需要9×105Tresp细胞和6×105Tregs(如果用较高的细胞数进行抑制试验,则相应地扩大细胞数)。 2. 将所需细胞数的细胞悬液转移到合适的管中。 3. 在细胞中加入5-10倍体积的抑制培养基,300×g离心10分钟。 完全吸出上清液 4. 用1800μL抑制培养基重悬Tresp细胞(9×105),用1200μL抑制培养基重悬Treg细胞(6×10⁵)。 注意:两种细胞悬液的浓度现在为5×105细胞/mL。 5. 吸取适当体积的Treg和Tresp细胞悬浮液在96孔培养板。 请参考“准备Treg Suppression Inspector,人”中的表格,以获得相应的体积。 | |||||
Tresp:Treg | Tresp | Treg (5×105 cells/mL) | TregSuppression Inspector(1×105 MACSiBead Particles/mL) | 培养基 | |
| 1:0 | 100 µL | --- | 5 µL | 105 µL | |
| 1:1 | 100 µL | 100 µL | 10 µL | --- | |
| 2:1 | 100 µL | 50 µL | 7.5 µL | 53 µL | |
| 4:1 | 100 µL | 250 µL | 6.5 µL | 79 µL | |
| 8:1 | 100 µL | 12.5 µL | 6 µL | 92 µL | |
| 0:1 | --- | 100 µL | 5 µL | 105 µL | |
| 1:0 | 100 µL | --- | --- | 110 µL | |
| 0:1 | --- | 100 µL | --- | 110 µL | |
| 总量 | 600 µL | 387.5 | 40 µL | 654 µL | |
| 三次重复总量 | 1800 µL | 1200 | 120 µL | ~2 mL | |
孵育 抑制检测在 37 °C,5–7% CO2孵育5天。 | |||||
| 07.体外抑制功能流式检测 | |
| 所需试剂 | 操作流程 |
免疫荧光染色 1. 将每个培养孔中的细胞悬液转移到5mL分离管中,收集细胞。 2. 每1×10⁷ 细胞用1-2mL分离液洗涤, 4 °C, 300×g离心10分钟。弃上清。 3. 用50 μL缓冲液重悬细胞。 4. 加入CD4和 CD25荧光抗体各5 μL。 5. 加入40μL缓冲液。 6. 混合均匀,2–8 °C避光孵育10分钟。 7. 每1×10⁷ 细胞用1-2mL分离液洗涤, 4 °C, 300×g离心10分钟。弃上清。 8. 重悬细胞在合适的体积用于下游流式分析。 | |

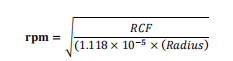
 产品顾问1
产品顾问1